Techniques d’Elaboration des Poudres:
Les poudres sont élaborées à partir de précurseurs par deux
types de procédés qualifiés de voie
sèche (calcination, pyrolyse,
broyage mécanique…) et
de voie humide
(précipitation à partir d’une solution, d’un sel fondu, coprécipitation,
procédé sol-gel).
1) Poudres : voie
sèche
le cycle de préparation
des poudres consiste à mélanger
des matières premières pulvérulentes, puis à
les calciner
afin de former les
phases recherchées par chimie
à l’état solide.
L’évolution de la technologie a suscité la mise au point
de modes de préparation
spécifiques par diverses voies
chimiques
« liquides » permettant un meilleur contrôle de
la granulométrie et de la morphologie des
poudres ainsi
que de la pureté et du
dopage.
Matières
premières de base pulvérulentes :
Elles sont constituées
d’oxydes, de carbonates, de nitrates, etc.
Une poudre idéale peut
être décrite comme étant formée de grains de petite taille (de l’ordre de
1 µm), ne s’agglomérant pas, de forme régulière, avec une répartition de
taille très serrée, et de pureté ainsi que de dopage contrôlés.
•Mélange.
Broyage
Cette opération a pour
effet de broyer les matières premières ou les chamottes, mais surtout de
mélanger les divers constituants : matériaux de base, chamottes, ajouts
divers. C’est également au cours de cette opération que sont dispersés les
agglomérats de grains dont sont généralement formées les poudres minérales.
Chamottage ou
calcination
Cette opération consiste
à faire subir aux matiéres pulvérulentes un cycle
thermique, éventuellement sous atmosphère contrôlée, au cours duquel elles
vont, par des phénomènes de diffusion en phase solide, réagir, et former la
phase cristalline recherchée.
Le chamottage se fait dans des fours
qui sont le plus souvent des fours continus .
Exemple
de synthèse par voie sèche de K2EuNb5O15
1/2Eu2O3 + K2CO3 + 5/2
Nb2O5 ------>>>>>K2EuNb5O15 + CO2


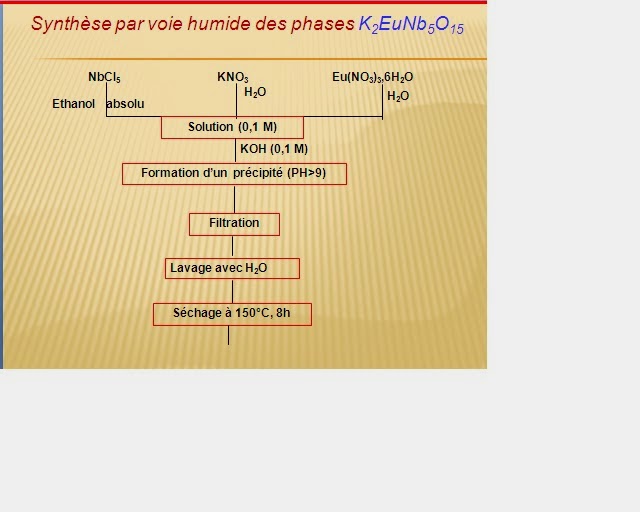
2) Poudres par Voie Humide: Coprécipitation/ Sol-Gel
Ce Concept, consiste à former des précipités ou des gels
à partir d’une solution homogène contenant les cations désirés, puis à calciner
ces précipités pour former la phase et la microstructure recherchées. Ces techniques
permettent, en principe, d’obtenir :
- Des poudres à répartition granulométrique étroite et homogène à l’échelle moléculaire ;
- Des poudres de haute pureté dont le contrôle de la stœchiométrie est aisé ;
- Des poudres menant par mise en forme et frittage à des
céramiques denses à microstructure contrôlée. Co-précipitationLes composés qui se préparent à des températures très élevées supérieures à 1100°C. peuvent être obtenus par voie liquide (Chimie douce). Cette méthode met en jeu des réactions de chimie en solution et conduit à l’obtention de matériaux à des températures plus basses (<< 1000°C) avec des grains de taille très faible et une meilleure cristallinité
Synthèse par voie humide des phases K2LnNb5O15
(Ln = La et Eu)

LE COEF DE PERMITIVITE EST TRES ELEVE DANS LA VOIE HUMIDE CAD UNE
GRANDE PERFERMANCE VOILA CA RENTRE DANS LA PROP MECANIQUES DES
MATERIAUX.
Préparation des phases K2EuNb5O15 par cooprécipitation à
ØDiminution
de la température de préparation et de
frittage à Gain d’énergie
ØAugmenter
la valeur de e’r
à Bonne performance du
matériau
MEB de K2EuNb5O15
préparé par voie solide
et co-précipitation


 M.EssaadaouI
M.EssaadaouI
